CENTRE DE REFERENCE
MALADIE DE RENDU-OSLER
Service de Génétique
Hôpital Femme - Mère - Enfant
Bâtiment A1 - 4éme étage
Groupement Hospitalier Est
59 Boulevard Pinel
69677 BRON Cedex
Tél. 04 27 85 65 25
Protocoles de Recherche Clinique - Etudes terminées
BABH :
Efficacité et tolérance du Bévacizumab pour le traitement des hémorragies sévères chez les patients porteurs de la maladie de Rendu-Osler. Etude nationale, randomisée, multicentrique de phase III.
Le bevacizumab est un anticorps utilisé et prescrit pour son action « contre la formation de nouveaux vaisseaux » dans le
traitement de certains cancers. Dans la maladie de Rendu-Osler son efficacité a pu être démontrée chez les patients ayant
une atteinte hépatique sévère avec un retentissement cardiaque. Il est aujourd’hui important de montrer, dans le cadre d’un
essai clinique, l’efficacité du bévacizumab sur les hémorragies sévères liées à cette pathologie (digestives et/ou épistaxis),
nécessitant des transfusions itératives. Cette étude est réalisée en collaboration avec les centres de compétence,
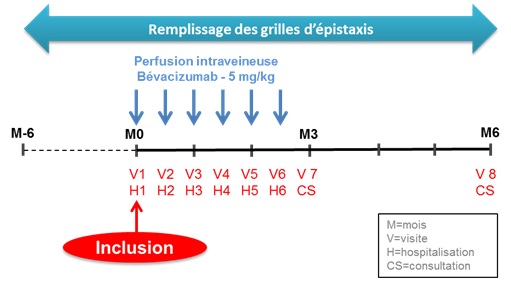
24 patients participeront et les inclusions réalisés dans 4 centres : Lyon, Montpellier, Ambroise Paré et Angers.
Le traitement, par voie intraveineuse, comporte 6 injections toutes les 2 semaines, l’attribution du traitement actif
(5 mg/kg) ou placebo (sérum physiologique pour la moitié des patients) se fait au hasard et en aveugle.
La durée de participation était de 6 mois, 2,5 mois de traitement et 3,5 mois de suivi.
Etude CONCERTO
La grossesse chez les patientes atteintes de la maladie de Rendu-Osler est considérée à haut risque.
En effet, des complications sévères (insuffisance cardiaque, hémorragie intracrânienne ou pulmonaire et un accident vasculaire cérébral)
ont été rapportées chez certaines femmes atteintes de la maladie de RO durant leurs grossesses (Shovlin et al. 2008).
Ces complications surviennent le plus souvent au cours des deuxième et troisième trimestres lorsque les changements maternels tels que
la vasodilatation périphérique et l'augmentation du débit cardiaque sont à leur maximum. Des études sur ce sujet ont été menées,
le plus souvent de manière rétrospectives (avec des effectifs variant de 40 à 97 patientes) et mettent en évidence l’importance
d’un dépistage précoce des complications et d’une prise en charge spécifique (Shovlin et al. 2008 ; de Gussem et al. 2014).
Le but de cette étude était de décrire les complications obstétricales et néonatales chez les patientes atteintes de la maladie de
Rendu-Osler. Cette étude a été menée au centre de référence à Lyon sur 1 an de manière rétrospective à travers un questionnaire
téléphonique et a permis d’inclure 207 patientes.
TACRO :
Efficacité et tolérance du Tacrolimus 0.1% en pommade nasale pour le traitement des épistaxis dans la maladie de Rendu-Osler. Etude multicentrique randomisée en double insu contre placebo (ratio 1 :1).
Le tacrolimus est un immunosupresseur. Il existe sur le marché sous forme de pommade, Protopic® 0.1%, pour le traitement de l’eczéma.
Ses propriétés anti-angiogéniques (qui limitent la prolifération des vaisseaux) en font une option thérapeutique intéressante
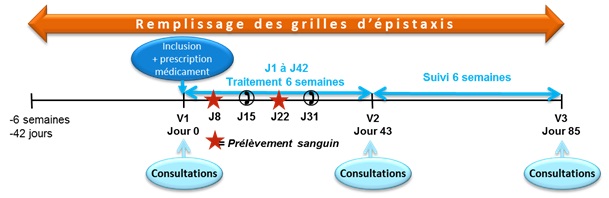
dans la maladie de Rendu-Osler. Cet essai a été mené dans trois centres : Lyon, Montpellier et Clermont-Ferrand avec la participation
de 50 patients pendant 18 mois. La pommade, actif ou placebo, a été prescrite au patient pour 6 semaines de traitement avec
une posologie de 2 administrations dans chaque narine par jour.
L’attribution du traitement actif ou placebo (la moitié des patients) a été faite au hasard et en aveugle.
La période de suivi était de 6 semaines après la fin du traitement.
TEMPO :
Efficacité du timolol en administration nasale pour le traitement des épistaxis dans la maladie de Rendu-Osler.
Les bétabloquants (tel que le timolol) ont des propriétés anti-angiogéniques qui ont été montré en dermatologie.
L’intérêt de ce produit dans la maladie de Rendu-Osler n’a été que peu étudié et il semble intéressant de le tester en spray nasal pour
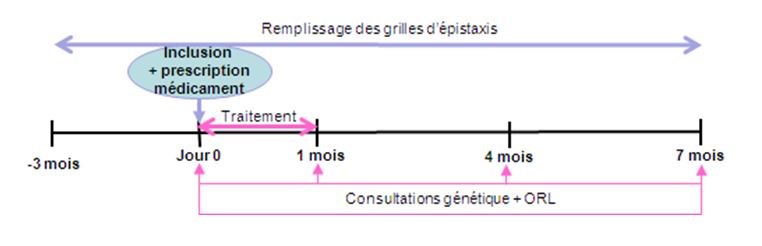
le traitement des épistaxis. Cet essai a été mené au niveau régional avec la participation de 58 patients recrutés à Lyon sur 2 ans.
Le produit, actif ou placebo (la moitié des patients), a été prescrit au patient pour un mois de traitement avec une posologie
d’une pulvérisation dans chaque narine 3 fois par jour. L’attribution du traitement actif ou placebo a été faite au hasard et en aveugle.
La période de suivi était de 6 mois après la fin du traitement.
Les résultats de cette étude ont été publiés dans une revue scientifique :
Efficacy of TIMOLOL nasal spray as a treatment for epistaxis in hereditary hemorrhagic telangiectasia. A double-blind, randomized, placebo-controlled trial. Sci Rep. 2019 Aug 19;9(1):11986.
Dupuis-Girod S, Pitiot V, Bergerot C, Fargeton AE, Beaudoin M, Decullier E, Bréant V, Colombet B, Philouze P, Faure F, Letievant JC.
Alegori :
Efficacité du bevacizumab en spray nasal pour le traitement des épistaxis dans la maladie de Rendu-Osler.
Cet essai national, conduit avec la participation des centres de compétences répartis sur le territoire français a débuté
en 2014. Trois doses de bevacizumab ont été testées : 25 mg, 50 mg et 75 mg et comparées à un placebo (1/4 des patients).
Le traitement consistait à 3 administrations de produit, réalisées par spray nasal à l’hôpital et espacées de 2 semaines,
la période de suivi était de 6 mois. Lors de cette première phase 80 patients ont été inclus, 20 dans chaque groupe.
Les données obtenues ont été traitées statistiquement et un comité indépendant s’est réuni afin d’analyser les résultats.
L’objectif du comité était de conserver la dose la plus efficace pour poursuivre les inclusions dans une deuxième étape
prévue par le protocole. Malheureusement, aucun des quatre groupes n’a montré d’amélioration des épistaxis.
Aucune efficacité du bevacizumab n’a pu être mise en évidence, l’étude a donc été arrêtée prématurément sans la réalisation
de l’étape 2.
Les résultats de cette étude ont été publiés dans une revue scientifique :
Effect of Bevacizumab Nasal Spray on Epistaxis
Duration in Hereditary Hemorrhagic Telangectasia: A Randomized Clinical Trial. Dupuis-Girod S, Ambrun A, Decullier E,
Fargeton AE, Roux A, Bréant V, Colombet B, Rivière S, Cartier C, Lacombe P, Chinet T, Blivet S, Blondel JH,
Gilbert-Dussardier B, Dufour X, Michel J, Harle JR, Dessi P, Faure F. JAMA. 2016 Sep 6;316(9):934-42.
doi: 10.1001/jama.2016.11387.
Une étude américaine (NOSE) publiée dans la même revue n’a pas mis en évidence non plus d’efficacité du bevacizumab en
administration nasale.
Atero :
Essai clinique randomisé de l’Acide Tranexamique sur les épistaxis de la maladie de Rendu-Osler – Effets bénéfiques ou iatrogènes.
Cette étude a été mise en place pour tester l’efficacité de l'acide tranexamique en prise orale dans le traitement des épistaxis, estimée par le temps moyen mensuel d'épistaxis. Ce traitement est en effet pris régulièrement par les patients, sans que l’efficacité à ce jour, n’ait été démontrée.
Il s’agit d'un essai clinique comparatif randomisé en quadruple insu contre placebo, en plan croisé pour deux périodes de trois mois déterminées aléatoirement (alternant placebo ou molécule active) sur une durée de six mois.
Cette étude est terminée depuis 2010. Au total 170 patients ont été inclus et 135 randomisés.
Cette étude a montré que pendant la phase de traitement par Exacyl, la durée moyenne des épistaxis était inférieure à la durée observée pendant la phase de traitement par placebo. La différence moyenne est d’environ 10 min/mois entre les deux groupes, avec bien sûr, des variations individuelles, c'est-à-dire des patients qui ne sont pas du tout améliorés, à l’inverse des patients qui ont eu une amélioration supérieure à 10 min.
(Gaillard S, Dupuis-Girod S, Boutitie F, Rivière S, Morinière S, Hatron PY, Manfredi G, Kaminsky P, Capitaine AL, Roy P, Gueyffier F, Plauchu H; The ATERO Study Group. Tranexamic acid for epistaxis in hereditary hemorrhagic telangiectasia patients: a European cross-over controlled trial in a rare disease. J Thromb Haemost. 2014 Sep;12(9):1494-502.)
Sonovue :
Comparaison du scanner hépatique et de l’échographie avec produit de contraste (Sonovue®) chez les patients atteints de la maladie de Rendu-Osler avec échographie Doppler normale.
Afin d’évaluer la sensibilité d’un nouvel examen diagnostic potentiellement très intéressant, l’échographie avec produit de contraste (Sonovue®), chez les patients atteints de maladie de Rendu-Osler pour le dépistage de atteintes hépatiques, une étude prospective a été menée. Les patients vus consécutivement à la consultation du Centre de Référence ont été informés de la possibilité de participer à cette étude sur l’évaluation de l’échographie de contraste dans la maladie de Rendu-Osler.
Cette étude s’est terminée en février 2010, au total 29 patients ont été inclus.
Cette étude a montré que l’échographie Sonovue® avait une excellente sensibilité pour le diagnostic, comparable à celle du scanner. Toutefois, elle nécessite un opérateur expérimenté.
Description de l’évolution des paramètres d’échographie cardiaque lors d’atteintes hépatiques sévère de la maladie de Rendu-Osler
Tous les patients vus consécutivement par le centre de Référence entre mai 2007 et novembre 2009, présentant une dyspnée à l’effort ou au repos et/ou des signes cardiologiques ont été adressés au Dr Isabelle Ginon (Praticien Hospitalier en cardiologie) pour un avis cardiologique et une évaluation de l’index cardiaque par échographie cardiaque.
Cette étude a permis de montrer l’intérêt de la surveillance cardiologique dans la maladie de Rendu-Osler et les critères à surveiller pour évaluer la gravité de l’atteinte hépatique et de son retentissement cardiaque qui va conditionner le traitement.
Un article a été publié en 2012 sur ces résultats (Ginon I et al. Hereditary hemorrhagic telangiectasia, liver vascular malformations and cardiac consequences. Eur J Intern Med. 2013 Apr;24(3):e35-9.)
Metafore : Maladie de Rendu-Osler : Etude de l’efficacité et de la tolérance du Bevacizumab utilisé pour le traitement des formes hépatiques sévères. Etude de phase II.
Le bevacizumab est un anticorps monoclonal connu pour ses propriétés anti-angiogéniques. Après la description dans la littérature de cas où des personnes, atteintes de Rendu-Osler, avaient été améliorés par un traitement par le bevacizumab, il était important de confirmer cette efficacité avec un essai clinique spécifique.
L’étude débutée en 2009 est terminée depuis fin 2011, 25 patients, avec une atteinte hépatique sévère accompagnée d’un hyperdébit cardiaque, ont été traités. La posologie des injections IV de bevacizumab était de 25 mg/kg avec 6 cures espacées de 2 semaines.
Les résultats ont été très satisfaisants puisque chez 23 patients il a été observé une diminution de l’hyperdébit cardiaque (avec normalisation des valeurs chez 5 d’entre eux) induit par l’atteinte hépatique, ainsi qu’une diminution significative des épistaxis (de 221 minutes par mois en moyenne avant le traitement à 42 minutes par mois 6 mois après le début du traitement).
Les résultats de cette étude ont été publiés dans une revue scientifique : S. Dupuis-Girod, I. et al. Use of Bevacizumab among patients with hereditary hemorrhagic telangiectasia associated with severe hepatic vascular malformations and high cardiac output. JAMA 2012, 307;9:948-955.
Grâce à ce travail, une RTU (Recommandations Temporaire d’Utilisation) a été demandée pour l’utilisation du bevacizumab dans la maladie de Rendu-Osler et plusieurs patients ont pu bénéficier de ce traitement.
La durée de l’amélioration après un traitement par bevacizumab est variable d’un patient à un autre.
Etude pharmacocinétique dans le cadre de l’étude Métafore.
Lors du protocole Métafore, des prélèvements sanguins ont été réalisés afin de voir si l’on pouvait prévoir la réponse des patients en fonction des dosages pharmacocinétiques. L’étude est actuellement en cours.
Ellipse : Etude de phase I évaluant la tolérance du bevacizumab en spray nasal pour le traitement des épistaxis dans la maladie de Rendu-Osler.
Afin de limiter les effets indésirables systémiques du bevacizumab et de faciliter son administration, une application locale semble adaptée. Pour cette étude réalisée entre 2011 et 2013, 40 patients ont été inclus et ont reçu des pulvérisations de bevacizumab aux doses suivantes : 12,5 mg, 25 mg, 50 mg, 75 mg, et 100 mg, certains patients ont reçu un produit placebo.
Une excellente tolérance du produit a été observée.
Les résultats de cette étude ont été publiés dans une revue scientifique : S. Dupuis-Girod, et al. Ellipse study. A phase I study evaluating the tolerance of bevacizumab nasal spray in the treatment of epistaxis in hereditary hemorrhagic telangiectasia. mAbs 6:3, 1-6; May/June 2014; 2014 Landes Bioscience.
Grâce à ces résultats une étude d’efficacité peut être planifiée.

|

Filière des Maladies Vasculaires Rares
avec atteinte Multisystémique
|

| |
Centre National de Référence - Maladie de RENDU-OSLER







